Il tumore alla mammella (Breast Cancer) è, per incidenza e mortalità, il primo tumore nel sesso
femminile. Si stima che, nell’arco della propria vita, circa 1 donna su 8 (12% circa) svilupperà questo tipo di tumore.
La gran parte dei tumori della mammella, circa 90%, è considerata sporadica ma si stima che la restante parte possa essere attribuita a forme ereditarie causate da fattori genetici costituzionali di predisposizione ai tumori solidi.
Nell’uomo invece il tumore della mammella costituisce meno del 1% dei tumori, con un rischio di malattia nell’arco della vita inferiore a 1/1000. Per via della sua rarità il tumore della mammella maschile (Male Breast Cancer) è infatti considerato un elemento di sospetto di una forma ereditaria (condizione confermata in circa il 10% dei casi).
Quali sono i criteri per accedere alla consulenza genetica
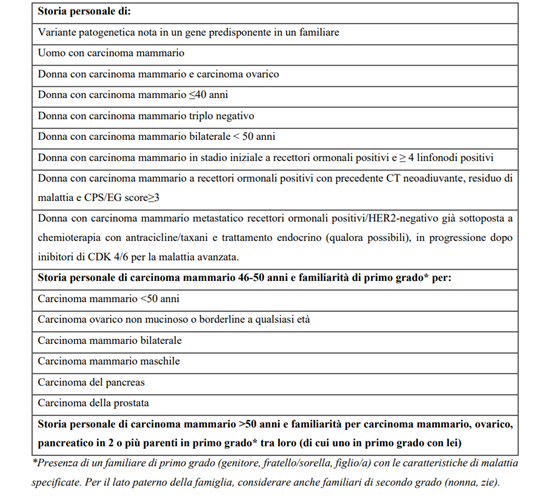
La consulenza oncogenetica rappresenta il primo step del percorso perché l’indicazione all’esecuzione di test genetici finalizzati alla ricerca di mutazioni in geni di predisposizione deve necessariamente tenere conto di alcuni criteri, quali la familiarità, il tipo di neoplasia, l’età alla diagnosi e le caratteristiche istologiche, immuno-istochimiche e molecolari dei tumori. Queste indicazioni hanno portato alla stesura di criteri ben definiti riportati nelle Linee Guida AIOM – Associazione Italiana Oncologia Medica – (Tabella n.1) che sono in accordo con quelli presenti nelle linee guida internazionali.
I geni BRCA1 e BRCA2
Negli anni ’90 furono scoperti i geni BRCA1 e BRCA2, responsabili di circa il 25-30% dei casi di tumore ereditario della mammella e/o dell’ovaio. La presenza di varianti patogenetiche (VP), cioè varianti associate ad un alto rischio di tumore in questi geni è trasmessa con modalità autosomica dominante ad alta penetranza e predispone all’insorgenza di numerose patologie oncologiche, conferendo al soggetto portatore un rischio che incrementa nel corso della vita rispetto alla popolazione generale di tumori correlati alla sindrome HBOC (prostata, pancreas, colon, tiroide ecc.).
Il rischio di trasmissione è quindi del 50% per ogni figlio indipendentemente dal sesso del genitore portatore della variante patogenetica e del sesso del figlio.
Si stima che il rischio cumulativo medio di sviluppare una neoplasia mammaria ed ovarica, a 80 anni in donne con VP BRCA, corrisponde al 72% per carcinoma mammario e 44% per carcinoma ovarico quando è coinvolto BRCA 1; 69% per carcinoma mammario e 17% per carcinoma ovarico in caso di VP a carico del gene BRCA 2.
Il carcinoma mammario ereditario ha un’alta probabilità di insorgenza precoce (donne di età <40), è spesso multifocale o multicentrico e con caratteristiche biologiche aggressive (G3, alta attività proliferativa, recettori ormonali negativi). Entrambi i geni sono inoltre responsabili di un rischio di carcinoma della mammella maschile di circa il 10%.
Le diverse casistiche mostrano anche un leggero incremento (6-14%) del rischio di sviluppare carcinoma della prostata, del colon e del pancreas. Circa 1-2% di tutti gli adenocarcinomi del pancreas, indipendentemente dalla storia familiare, mostrano VP germinali nei geni BRCA 1 e/o BRCA 2; invece i pazienti con storia familiare mostrano VP nei geni BRCA 1 e/o BRCA 2 nel 10-20%.
Nello specifico, per i portatori di VP in BRCA 2, il rischio nell’arco della vita di sviluppare il tumore del pancreas è stimato tra il 5% e il 10%; mentre per i portatori di VP in BRCA 1 viene stimato un rischio aumentato dalle due alle quattro volte (3% nell’arco della vita ).
I portatori sani di VP hanno un rischio relativo di sviluppare un tumore pancreatico dalle 2 alle 7 volte in più rispetto ai non portatori.
Risulta importante sottolineare come individui portatori di VP non presentino la certezza di sviluppare il tumore nel corso della loro vita, ma presentino un incremento delle probabilità di sviluppare il tumore rispetto alla popolazione generale.
L’importanza del test genetico
Il riscontro di una variante patogenetica germinale nei geni BRCA1 e BRCA2 consente di valutare il rischio di sviluppare una seconda neoplasia e di poter quindi avviare percorsi di prevenzione primaria e secondaria nelle donne ad alto rischio genetico nonché programmi di chirurgia profilattica di riduzione del rischio.
Inoltre oggi, il riscontro di una variante patogenetica nei geni BRCA1/2 ha anche importanti implicazioni terapeutiche per le donne affette da carcinoma mammario (test BRCA come test predittivo di efficacia delle terapie antitumorali) come sottolineato nelle Raccomandazioni 2019 per l’implementazione del test BRCA nelle pazienti con carcinoma mammario e nei familiari a rischio elevato di neoplasia a cura del Gruppo di Lavoro AIOM-ANISC-SICO-SIGU-SIBIOC-SIAPEC-IAP.
Altri geni implicati nel rischio di tumore alla mammella
Negli anni sono stati individuati altri geni implicati nella predisposizione ereditaria a tumori alla mammella. Questi geni in relazione al rischio conferito possono essere classificati ad alta, media e bassa penetranza.
Tra questi geni, i principali sono TP53, STK11, PTEN, CDH1 che conferiscono un elevato rischio oncogenetico anche a carico di altri organi, PALB2 che conferisce un rischio medio/alto, CHEK2 e ATM che si associano ad un rischio intermedio.
Il programma BRACAnext
Nell’ottica di offrire alle pazienti con carcinoma della mammella, dell’ovaio o con neoplasie correlate un percorso oncogenetico avanzato all’interno del percorso Oncogenetic Care di BGenetica è stato messo a punto il programma BRACAnext (BReast Advanced Cancer Analysis di next generation).
Questo programma, avvalendosi della collaborazione di Laboratori di Genetica Italiani ed Internazionali, attraverso le più avanzate analisi di genomica, permette di caratterizzare l’eventuale presenza di mutazioni in geni diversi rispetto ai più noti BRCA1 e 2, caratterizzando il rischio oncogenetico individuale.
Individuata la presenza di una mutazione patogenetica attraverso il programma di prevenzione oncologica inserito nel percorso Oncogenetic Care sarà possibile eseguire la ricerca “single site” della variante familiare negli altri soggetti individuando quindi eventuali altri familiari a rischio di neoplasia ed attivando specifici percorsi di prevenzione.
Per ulteriori approfondimenti puoi contattare i genetisti di Bgenetica o, qualora dovessi rientrare in una delle condizioni prima illustrate, valutare la possibilità di eseguire una consulenza genetica.
a cura di Cristina Gorgone – Medico Genetista
Bibliografia
- Valencia OM, Samuel SE, Viscusi RK, Riall TS, Neumayer LA, Aziz H. The Role of Genetic Testing in Patients With Breast Cancer: A Review. JAMA Surg. 2017 Jun 1;152(6):589-594
- Leon-Ferre RA, Giridhar KV, Hieken TJ, Mutter RW, Couch FJ, Jimenez RE, Hawse JR, Boughey JC, Ruddy KJ A contemporary review of male breast cancer: current evidence and unanswered questions. .Cancer Metastasis Rev. 2018 Dec;37(4):599-614.
- Mahdavi M, Nassiri M, Kooshyar MM, Vakili-Azghandi M, Avan A, Sandry R, Pillai S, Lam AK, Gopalan V. Hereditary breast cancer; Genetic penetrance and current status with BRCA. J Cell Physiol. 2019 May; 234(5):5741-5750
- Tung NM, Garber JE. BRCA1/2 testing: therapeutic implications for breast cancer management. Br J Cancer. 2018 Jul;119(2):141-152
- Lee A, Moon BI, Kim TH. BRCA1/BRCA2 Pathogenic Variant Breast Cancer: Treatment and Prevention Strategies. Ann Lab Med. 2020 Mar;40(2):114-121
- Nelson HD, Pappas M, Cantor A, Haney E, Holmes R. Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer in Women: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. 2019 Aug 20;322(7):666-685.