A cura di Claudia Di Napoli – Medico Genetista
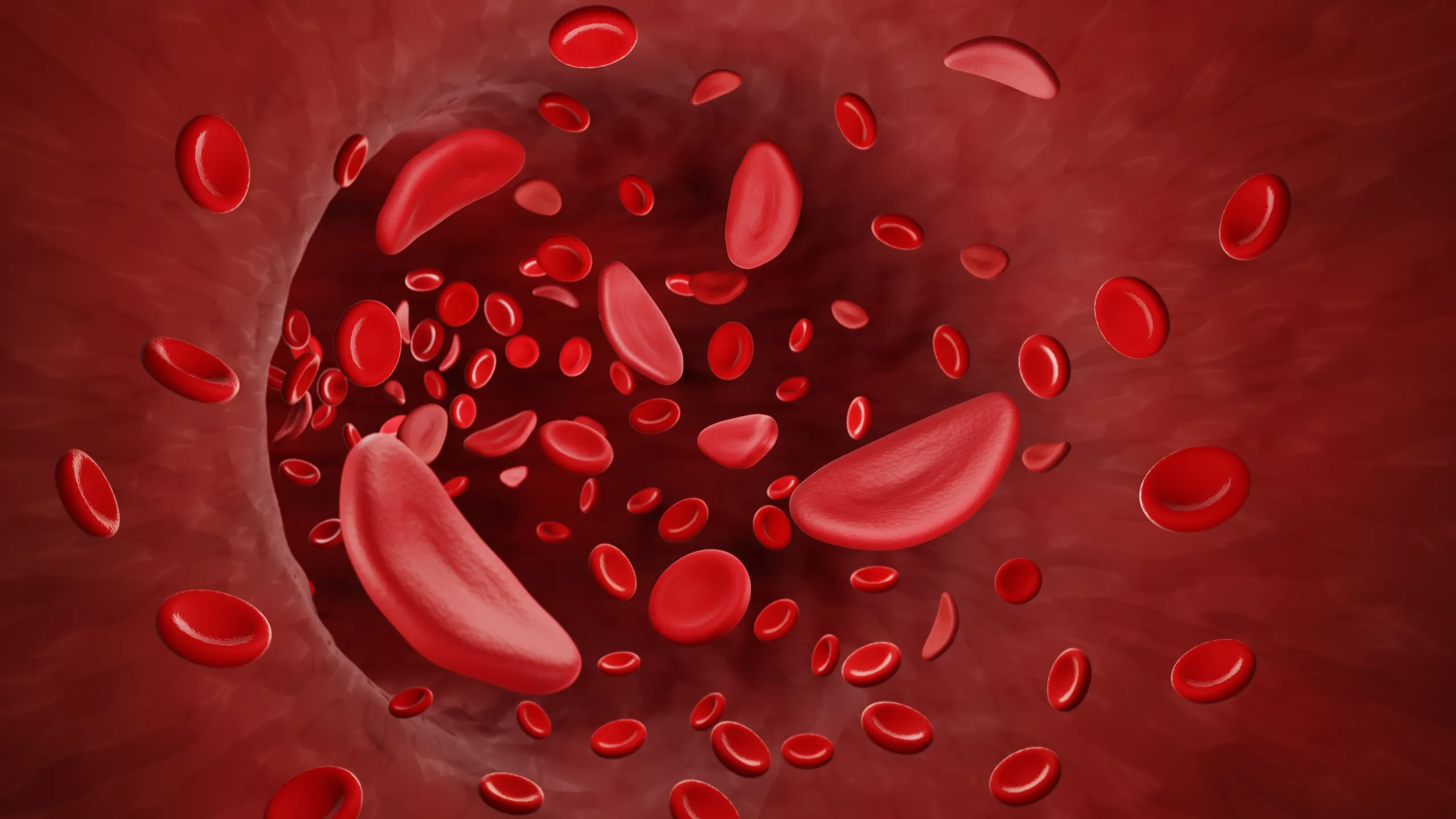
L’anemia falciforme o drepanocitosi è una malattia genetica del sangue che colpisce principalmente i globuli rossi, rendendoli rigidi e deformati in una forma caratteristica a mezzaluna o “falce”.
Questa forma anomala ostacola il normale passaggio dei globuli rossi nei vasi sanguigni, causando anemia cronica, episodi dolorosi e diverse complicanze a lungo termine.
Eziologia
L’anemia falciforme è causata da mutazioni genetiche che modificano l’emoglobina, la proteina responsabile del trasporto dell’ossigeno nel sangue, chiamata emoglobina S o HbS, dall’inglese Sickle=falce. Nelle persone affette infatti l’emoglobina mutata in determinate condizioni di stress, quali ad esempio infezioni, disidratazione, bassa ossigenazione, precipita all’interno del globulo rosso e lo deforma: da sferico e flessibile, si irrigidisce e si incurva assumendo la caratteristica forma a falce. I globuli rossi così deformati occludono i vasi ematici causando crisi dolorose che coinvolgono principalmente le ossa degli arti, la colonna dorso-lombare e le articolazioni; anche altri organi ed apparati (milza, polmoni, encefalo, retina) possono essere interessati dagli eventi vaso-occlusivi.
Epidemiologia
Questa forma di anemia è diffusa in particolar modo nelle popolazioni africane, del bacino del Mediterraneo, del Medio Oriente e dell’India. Si stima che circa il 5% della popolazione mondiale sia portatrice di geni dell’emoglobina anomala, con circa 300.000 nuovi casi di anemia falciforme ogni anno nel mondo. In Italia, pur essendo meno comune, si riscontrano ormai numerosi casi dovuti ai flussi migratori e come conseguenza di un meccanismo evolutivo nelle zone in cui era/è diffusa la malaria, in quanto i portatori sani dell’alterazione genica che causa l’anemia falciforme hanno una maggiore resistenza ai plasmodi che causano la malaria.
Genetica
L’anemia falciforme è causata dalla presenza di mutazioni nel gene HBB, che codifica per le catene beta dell’emoglobina, localizzato nel cromosoma 11.
Si tratta quindi di una patologia genetica ed ereditaria, che si trasmette con modalità autosomica recessiva: una persona sviluppa la malattia solo se possiede una mutazione su ciascuna delle due copie del gene HBB (almeno una delle quali è quella HbS-relata), ereditate da entrambi i genitori. Se un individuo presenta una sola copia del gene mutato è definito portatore sano o “tratto falcemico”, non presenterà solitamente i sintomi della malattia, ma potrà trasmettere il gene mutato ai figli.
Sulla base di questa modalità di trasmissione, una coppia di portatori sani ha una probabilità di avere un figlio con anemia falciforme pari al 25% per ogni gravidanza, indipendentemente dal sesso del nascituro.
Caratteristiche Cliniche
L’anemia falciforme è una malattia ereditaria complessa che può compromettere significativamente la qualità della vita. I sintomi sono variabili e possono includere:
- Crisi dolorose: sono episodi acuti di dolore intenso causati dal blocco dei vasi sanguigni da parte dei globuli rossi falciformi a livello delle articolazioni, dell’addome, o di specifici organi, che si presentano con frequenza variabile da soggetto a soggetto (episodici o costanti).
- Anemia: poiché i globuli rossi deformi sono più fragili, si distruggono più velocemente, riducendo il numero complessivo di globuli rossi e provocando pallore, stanchezza e debolezza (astenia).
- Ittero: la rapida distruzione dei globuli rossi può causare un eccesso di bilirubina nel sangue, provocando l’ingiallimento della pelle e degli occhi.
- Rischio d’infezioni: la malattia danneggia anche la milza, l’organo che aiuta a combattere le infezioni, rendendo i pazienti più vulnerabili ed esposti a contrarre malattie infettive.
- Complicanze: epatosplenomegalia, sindrome toracica acuta, crisi aplastica, sequestro splenico, insufficienza renale, danni oculari e problemi cardiaci.
Esiste una certa variabilità nella severità della sintomatologia tra i diversi pazienti e non è possibile prevedere con precisione l’esordio, l’entità e la tipologia delle complicanze che ciascun soggetto affetto potrà sviluppare. La percentuale di HbS è uno dei fattori principalmente implicato in questa variabilità e, a sua volta, dipende in primo luogo dal genotipo: la presenza in un soggetto affetto di due mutazioni HbS-relate o la combinazione di una mutazione HbS-relata con un’altra mutazione correlata a beta talassemia di tipo severa (beta°) determina in genere percentuali elevate di HbS circolante e quindi forme più severe della condizione; la combinazione invece con una mutazione più lieve (beta+), determina solitamente percentuali minori di HbS, che correlano con quadri clinici più moderati. I soggetti che presentano una variante per l’emoglobina S e una variante per la talassemia beta si definiscono affetti da talassodrepanocitosi.
Diagnosi
La diagnosi dell’anemia falciforme può essere effettuata tramite:
- Esami ematologici: riduzione dell’emoglobina e del numero dei globuli rossi (anemia), rialzo del numero dei reticolociti e aumento degli indici di emolisi (bilirubina e LDH).
- Striscio di sangue periferico: può mostrare la presenza dei globuli rossi a forma di falce.
- Elettroforesi dell’emoglobina: può identificare la presenza di emoglobina falciforme (HbS) nei globuli rossi.
- Test genetico: è possibile eseguire l’analisi molecolare per confermare la presenza delle mutazioni nel gene HBB. Il test è indicato sia nei soggetti con sintomatologia e sospetta diagnosi clinica, sia in soggetti sani in epoca preconcezionale per scoprire se una persona è portatrice sana della condizione.
Terapia
La diagnosi precoce, il monitoraggio regolare e l’adozione di comportamenti e terapie mirate possono aiutare a gestire meglio la malattia e prevenire complicanze gravi.
- Prevenzione: per le crisi dolorose i soggetti affetti devono cercare di evitare le condizioni che riducono la quantità di ossigeno nel sangue (sforzi intensi, disidratazione, improvvisi sbalzi di temperatura, attività ad alta quota); per le infezioni è necessario vaccinarsi e trattare tempestivamente ogni infezione anche lieve.
- Farmaci: l’idrossiurea è uno dei principali farmaci utilizzati per ridurre la frequenza delle crisi dolorose e aumentare i livelli di emoglobina. Altri farmaci, come antibiotici, acido folico, L-glutammina, sono usati per controllare i sintomi e le complicanze dell’anemia falciforme.
- Trasfusioni di sangue: in casi di crisi severe, le trasfusioni possono essere necessarie per aumentare i livelli di globuli rossi sani.
- Trapianto di midollo osseo o cellule staminali: è l’unica cura attualmente disponibile che può portare a una guarigione completa, ma è riservata a casi gravi e richiede un donatore compatibile, spesso un familiare stretto.
- Terapia genica: in fase emergente è la ricerca e la sperimentazione sulla terapia genica sia basata sull’inserimento nelle cellule precursori dei globuli rossi di un gene modificato per indurre la produzione di emoglobina normale (es. emoglobina fetale), sia basata sulla tecnologia di “gene editing” che mira a correggere direttamente la mutazione alla base della malattia.
Percorsi per Coppie ad Alto Rischio (Portatori Sani)
Le coppie in cui entrambi i partner risultano portatori sani di anemia falciforme possono valutare diversi percorsi procreativi, solitamente spiegati e discussi nell’ambito di una consulenza genetica in cui il medico specialista in genetica aiuta a comprendere i rischi di trasmissione e le diverse opzioni disponibili. In particolare, una volta note le varianti genetiche dei partner, è possibile accedere a:
- Diagnosi prenatale: in corso di gravidanza tramite procedura invasiva (villocentesi o amniocentesi) è possibile verificare la presenza o meno delle mutazioni nel feto in epoca precoce, offrendo alle coppie la possibilità di decisioni informate.
- Fecondazione assistita omologa con diagnosi genetica preimpianto (PGT): questa tecnica permette di analizzare gli embrioni (allo stadio di blastocisti) prima dell’impianto per selezionare quelli eventualmente non affetti dalla malattia, aumentando le probabilità di avere un bambino non affetto da anemia falciforme.
- Fecondazione assistita eterologa: questo percorso prevede un percorso di fecondazione assistita e la sostituzione di uno dei due partner portatore tramite ovodonazione/spermiodonazione per la riduzione del rischio di concepire prole affetta dalla condizione.
Associazioni Italiane per il Supporto a Pazienti e Famiglie
In Italia esistono diverse associazioni che offrono supporto ai pazienti e alle loro famiglie, sensibilizzano sull’anemia falciforme e promuovono la ricerca. Ecco alcune delle principali:
-
- UNITED Onlus- Federazione Italiana delle Thalassemie, Emoglobinopatie Rare e Drepanocitosi https://www.unitedonlus.org/
- Fondazione Italiana “Leonardo Giambrone” per la Guarigione dalla Talassemia e Drepanocitosi (FITHAD) https://www.fithadleonardogiambrone.com/
- Associazione Ligure Thalassemici OdV https://www.altodv.it/
- Associazione Veneta Lotta alla Talassemia https://www.avlt.it/
- Federazione Associazioni Siciliane di Talassemia Emoglobinopatie e Drepanocitosi – Sicilia Onlus (FASTED SICILIA ONLUS) https://www.fasted.it/
Bibliografia
- Bender MA, Carlberg K. Sickle Cell Disease. 2003 Sep 15 [Updated 2023 Dec 28]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2024. https://www.ncbi.nlm.nih.gov/books/NBK1377/pdf/Bookshelf_NBK1377.pdf
- “Diagnostica di I e II livello delle emoglobinopatie” Società Italiana Talessemia ed Emoglobinopatie (SITE) https://www.site-italia.org/storage/site/article/pdf/16/1-I_e_II_Final_Vers_02.pdf
- Haydar Frangoul, M.D., Franco Locatelli, M.D., Ph.D., Akshay Sharma, M.B., B.S., Monica Bhatia, M.D., Markus Mapara, M.D., Ph.D., Lyndsay Molinari, M.D., Donna Wall, M.D., Robert I. Liem, M.D., Paul Telfer, M.D., Ami J. Shah, M.D., Marina Cavazzana, M.D., Ph.D., Selim Corbacioglu, M.D., et al.* Exagamglogene Autotemcel for Severe Sickle Cell Disease. May 9, 2024. N Engl J Med 2024; 390:1649-1662 DOI: 10.1056/NEJMoa230967639018
- Hardouin G, Magrin E, Corsia A, Cavazzana M, Miccio A, Semeraro M. Sickle Cell Disease: From Genetics to Curative Approaches. Annu Rev Genomics Hum Genet. 2023 Aug 25;24:255-275. doi: 10.1146/annurev-genom-120122-081037. PMID: 37624668.
- OMIM Online Mendelian Inheritance in Man https://www.omim.org/entry/603903
- Orphanet Il portale delle malattie rare e dei farmaci orfani https://www.orpha.net/it/disease/detail/232?name=Drepanocitosi&mode=name